سندروم مویا مویا ( moya moya ) ناشی از تابش وسونوگرافی(Ultrasoun
سندروم مویا مویا ( moya moya ) ناشی از تابش
مقدمه :
بیماری
های عروقی ناشی از تشعشع از عوارض پرتودرمانی می باشند که به خوبی شناخته
شده اند و می توانند در زمان طولانی موجب مرگ و میر بیماران شوند. انسداد
پیش رونده اینتراکرانیال جریان خون شریانی, از جمله سندروم مویا مویا, یکی
از آثار دیررس و غیرعادی پرتودرمانی است که به تعداد زیادی ثبت شده است.
سندروم مویا مویا با تشکیل و ظهور یک شبکه عروقی غیرطبیعی جانبی مشخص می
شود که در نهایت منجر به بسته شدن خودبخودی عروق چرخه willis
می شود. به زبان ژاپنی, مویا مویا یعنی « ابری از دود » و به ظاهر
آنژیوگرافیک دودآلود این بیماری اشاره دارد (1). آنژیوگرام مغزی بهترین
روش برای تصویربرداری و تشخیص این بیماری است. معیار تشخیص عبارتست از
تنگی یا انسداد در بخش پایانی شریان کاروتید داخلی یا در بخش ابتدایی
شریانهای قدامی یا میانی مغز و شبکه عروقی غیر طبیعی در ناحیه تنگی و
اطراف آن.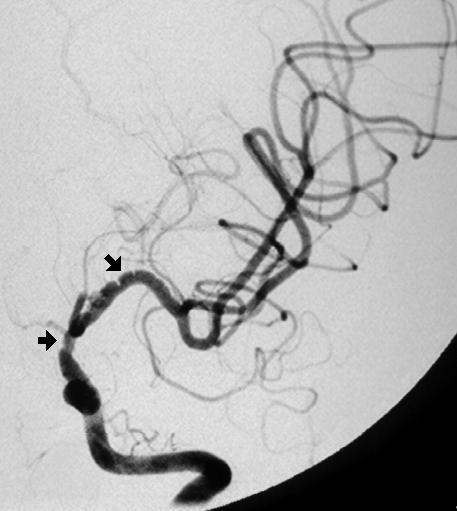
سبب شناسی ( etiology
) سندروم مویا مویا ناشناخته است. با این وجود این سندروم به عواملی نظیر
ارث, اختلالات خونی, عفونت سندرومهای مادرزادی, بیماریهای عروقی و
پرتودرمانی دیده شده است. در یک مطالعه , 2 نفر از 316 بیمار( NF-1 ( % 0.6 که تحت غربالگری با MRI مغزی قرار گرفتند مبتلا به سندروم مویا مویا بودند (2). عقیده بر این است که اختلالات عروقی همراه با 1- NF با نوروفیبرومین, یک محصول پروتئینی ژن 1- NF , که در سلولهای عضلانی صاف و پوششی عروق خونی بیان می شوند, همراه است. (3)
برای درک بهتر مشخصات بیمارانی که پس از پرتودرمانی دچار سندروم مویا مویا شده اند, ما به مرور موارد منتشر شده اخیر پرداخته ایم.مواد و روشها :
در ابتدا در شبکه medline/PubMed به جستجوی مقالات انگلیسی پرداختیم و از کلمات ( radiation ), ( radiotherapy ) و ( moya moya syndrome
) به عنوان کلمات جستجو استفاده کردیم. تشخیص بیماران با سندروم مویا مویا
از طریق راهنماهایی که وزارت بهداشت ژاپن تعریف کرده بود انجام شد (4). بر
اساس این راهنماها, آنژیوگرافی بیماران نشان از تنگی یا انسداد در بخشهای
پایانی شریانهای کاروتید داخلی یا بخشهای ابتدایی شریانهای صافی و قدامی
مغزی به همراه شبکه عروقی در نواحی فاز شریانی داشت. بیمارانی که در مورد
آنها تصور می شد تغییرات اختلالی عروقی ناشی از فشار ثانویه توده تومورال
است از مطالعه خارج شدند. 33 مقاله مربوط به سالهای 1976 تا 2002 مرور
شدند که در جدول 1 آمده اند. این مقالات شامل 54 بیمار با تشخیص سندروم
مویامویا ناشی از تابش بودند.
مقالات را مورد بررسی قراردادیم تا
پارامترهای وابسته به بیمار, تومور و درمان را به دست آوریم. فاکتورهای
وابسته به بیمار عبارتند از: سن هنگام تابش گیری, جنسیت, وجود NF-1
, سابقه بیماریهای عروقی و نقصهای مادرزادی. نوع تومور تحت تابش نیز برای
هر بیمار مورد بررسی قرار گرفت. فاکتورهای مرتبط با درمان عبارتند از :
دوز تشعشع, حجم درمان, استفاده ترکیبی از روش شیمی درمانی با پرتودرمانی,
تاریخچه جراحی تومور, موقعیت تغییرات عروقی و مدت زمان بین پرتودرمانی تا
تشخیص سندروم مویا مویا. حجم درمانی پرتودرمانی به دو بخش تقسیم شد:
پرتودرمانی Involved-Field یا Extensive-Field نظیر پرتودرمانی تمام مغز یا کرانیواسپانیال. برای مقایسه دوز تشعشع, دوره نهان تا وضعیت NF-1 , نوع حجم درمانی و استفاده از شیمی درمانی و جراحی از روش آماری Un paired-t-test استفاده شد. به علاوه آزمون یکطرفه A NOVA برای تحلیل رابطه دوز تشعشع و دوره نهان تا سن پرتودرمانی نوع تومور و جنسیت مورد استفاده قرار گرفت.نتایج :
در
جستجوی ما, 54 بیمار با سندروم مویا مویا ناشی از تابش ثبت شوند. متوسط سن
بیماران در 48 بیمار در اولین پرتودرمانی 8/3 سال بود ( محدوده ای از 47-
4/0 سال ). سن 6 نفر از بیماران ذکر نشده بود. توزیع سن مورد بررسی قرار
گرفت و نتایج آن در شکل 1 آورده شده است. از این موارد, 27 نفر (
%3/56 ) کودکانی بودند که در سنین کمتر از 5 سال پرتو دریافت کرده بودند.
در بین باقیمانده ها, 11 نفر ( % 9/22 ) بین سنین 5 تا 10 , 4 نفر (%3/8 )
بین 11 تا 20, 3 نفر ( % 3/6 ) بین 21 تا 30, 1 نفر ( % 1/2 ) بین 31 تا
40 و 2 نفر ( % 2/4 ) بین 41 تا 50 سالگی تحت تابش قرار گرفتند. توزیع
جنسی به این صورت بود که 18 مرد (% 6/34 ) و 26 زن ( %50 ) وجود داشت. در
10 بیمار (% 2/19 ) جنس ذکر نشده بود. 14 نفر از 54 نفر (% 9/25 ) مبتلا
به NF-1 تشخیص داده شدند. هیچ کدام از بیماران سابقه بیماری عروقی یا نقصهای مادرزادی نداشتند.
نوع تومور متغیر و برای تمام جمعیت بیماران موجود بود. بیشترین نوع توموری که تحت درمان پرتو درمانی قرار گرفت گلیومای Low-grade بود که در 37 فرد ( %5/68 ) مشاهده شد که 29 نفر از آنها optic glioma بود. بقیه تومورها از انواع نادرتری بودند و عبارتند از آدنوما غده هیپوفیز, Craniopharyngioma و germinoma . بیشتر تومورها در ناحیه Parasellar قرار داشتند.
بیماران بر اساس نوع تومورشان تحت درمان پرتودرمانی قرار گرفتند. دوز متوسط Gy 2/55 ( محدوده Gy 120-22 ) بود. دوز در 8 بیمار ذکر نشده بود. دوز پرتودرمانی نیز براساس حالت NF-1 مورد بررسی قرار گرفت .دوز متوسط برای بیماران با NF-1 مثبت Gy 5/46 ( محدوده Gy 55-22 ) و برای بیماران با NF-1 منفی, Gy 1/58 ( محدوده Gy 120- 24 ) بود ( 02/0 = P ) .
سندروم مویا مویا در دوزهای پائین ( > 30 Gy ) در 4 بیمار دیده شدکه همه آنها در زمان پرتودرمانی کمتر از 7 سال سن داشتند. از این 4 نفر, 2 نفر (%50 ) دارای NF-1 مثبت بودند. استفاده از جراحی ( 22/0 = P ), نوع تومور (21/0=P ) و سن در زمان شروع پرتودرمانی ( 2/0 = P ) تاثیری بر میزان دوز تشعشع نداشتند.
دوره
نهفته, زمان بین پرتودرمانی و تشخیص سندروم مویامویا در 47 بیمار مشخص
بود. متوسط دوره نهفته 40 ماه بود ( محدوده 240- 4 ماه ) فاصله نهفته بین
پرتودرمانی یا تشخیص سندروم مویا مویا در شکل 3 آورده شده است. سندروم
مویا مویا ناشی از تشعشع در 13 بیمار ( % 7/27 ) در 2 سال رخ داده است. در
25 بیمار ( % 2/53 ) در 4 سال , 35 بیمار ( % 4/74 ) در 6 سال, 37 بیمار
(% 7/78 ) در 8 سال, 41 بیمار ( % 2/87 ) در 10 سال و 45
بیمار ( % 7/95 ) در 12 سال رخ داده است. البته وقتی
دوره نهفته را براساس حجم درمانی تحلیل کردیم زمان مجموع آن کوتاهتر شد.
میزان آن 4/28 ماه برای پرتودرمانی با میدان involved و 3/66 ماه برای میدانهای comprehensive بود ( 014/0 = P ). فواصل به صورت مشخص تحت تاثیر حالت NF-1 ( 2/0 = P ), سن پرتودرمانی ( 69/0 = P ), نوع تومور ( 65/0 = P ) و استفاده از جراحی ( 87/0 = P ) قرار نگرفت.
حضور
سندروم مویامویا در جمعیت بیماران ما متغیر بود. نتایج آنژیوگرافی 49
بیمار در بررسی ما وجود داشت. تحلیل موقعیت نشان داد که شریان کاروتید
داخلی ( یک یا دو طرفه ) در 45 مورد ( % 9108 ), شریان سربرال میانی در 12
مورد ( % 5/24 ), شریان ارتباطی قدامی در 9 مورد ( % 4/18 ), شریان
ورتبرال در 2 مورد ( %401 ) و شریان ارتباطی خلفی در 4 مورد ( % 2/8 )
درگیر بوده اند. بیماریهای multivessel در % 6/79 بیماران وجود داشت. تعداد عروق درگیر تحت تاثیر NF-1 ( 11a = p ), سن پرتودرمانی ( 46/ 0 = P ), حجم درمانی ( 12/0 = P ) و نوع تومور ( 078/0 = P ) مشخص نبود.
بحث و بررسی : مشکلات عروقی ناشی از تشعشع اولین بار بوسیله Hodes و lee ( 22
) به عنوان یک اثر جانبی تشعشع شرح داده شدند. مشکلات انسدادی عروق مغزی
نظیر سندروم مویامویا می توانند باعث مرگ و میر در طولانی مدت بیماران
شوند. پاتولوژی میکروسکوپی بیماران نشاندهنده ضخیم شدن پوشش درونی رگها و
نکروز میانی است که همگی نشانه های تغییرات ناشی از تشعشع در عروق بزرگ
است (5). به دلیل انسداد, در حدود 50 تا 60 درصد افراد مبتلا وخیم شدن
پیشرونده حالات مربوط به سکته را تجربه می کنند.Maruyama
و همکارانش (16) گزارش کردند که شیوع مویامویا ناشی از تابش در بیماران کم
سن و سال تر, بیشتر است. در مقالات ژاپنی محدوده سن از 64-0 سال ( متوسط
301 سال ) ذکر شده است. در مقالات انگلیسی زبان تحت بررسی ما, متوسط سن
8/3 سال ( نزدیک به مقالات ژاپنی ) محاسبه شده است ( با محدوده ای از 47-
4/0 سال ). برخی اظهار کرده اند که اطفال به این دلیل به سندروم پس از
تابش حساسترند که عروق سیستم عصبی مرکزی آنها از نظر ساختاری نابالغ است
(33 ). براساس تحلیل ما, افرادیکه در سنین کم تحت تابش پرتو قرار می گیرند
دچار خطر بیشتری مبنی بر ابتلا به سندروم مویامویا هستند. تقریباً 80%
بیمارانی که مبتلا به سندروم مویا مویا شدند در سنین 10 و کمتر تحت تابش
قرار گرفته بودند و % 56 آنها در سنین کمتر از 5 سال پرتودرمانی شده
بودند.
مقالات, مطالب کمی در مورد رابطه بین دوز و انسداد عروقی پس از تابش داشتند. Bitzer و Topka ( 23 ) 40
بیمار مبتلا به اختلالات عروقی ناشی از تابش را بررسی کردند و اعلام
نمودند که میزان دوز یا نوع پرتو احتمالاً تاثیری بر توسعه اختلالات
عروقی ندارد. محدوده دوز در مطالعه وسیع, از 22 تا Gy 120 با میانگین Gy 2/55
متغیر بود. بر اساس مطالعات ما هیچ رابطه مشخصی بین دوز تشعشع و سندروم
مویامویا با استفاده از جراحی, نوع تومور و یا سن پرتودرمانی وجود ندارد.
رابطه بین تکنیکهای پرتودرمانی و اندازه تقطیع, با توسعه سندروم مویا مویا
غیر قابل بررسی است به دلیل اینکه در بسیاری از مقالات اطلاعاتی در این
زمینه وجود ندارد. با این وجود درمان با اندازه تقطیعهای بزرگتر احتمالاً
خطر ابتلا به این سندروم را افزایش می دهد.
اختلال عروقی نوروفیبروماتوز –1 از عوارض مشخص بیماری است که شریانها و وریدها با هر اندازه ای را تحت تاثیر قرار می دهد (2).
گرفتگی شریان ریوی, عروق مغزی, آئورت و به طور شایع تری شریان کلیوی به عنوان عامل ظهور NF-1 در مقالات ثبت شده است. با این وجود ارتباط بین NF-1 و آثار تشعشع بر تغییرات عروق مغزی هنوز از عدم قطعیت برخوردار است و اینکه عوارض عروقی بوسیله پرتودرمانی, NF-1 یا هر دو ایجاد شده اند روشن نیست. گزارشهای ثبت شده ای وجود دارد که بیماران با تشخیص بدخیمی مغز و NF-1 با توسعه انسداد عروق مغزی بدون هیچ گونه تابش گیری وجود داشته اند ( 38 و 14 ). مطالعه ای روی 6 بیمار با Optic glioma و NF-1 که به سندروم مویا مویا پس از تابش مبتلا شده بودند نشان داد که میانگین دوز برای بیماران با NF-1, Gy 39 و برای بیماران بدون NF-1 , Gy51 بوده است (18 ). مطالعه ما, با 54 بیمار, اثبات می کند که بیماران با NF-1 دارای آستانه دوز پائین تری برای ابتلا به سندروم مویا مویا پس از تابش هستند. میانگین دوز برای بیماران NF-1 مثبت , Gy 5/46 ( محدوده Gy 55-22 ) و برای بیماران NF-1 منفی Gy 1/58 ( محدوده Gy 110-24 ) می باشد.
سندروم مویا مویا تشکیل شبکه عروق غیر طبیعی است که منجر به بسته شدن عروق مجاور در چرخه willis می شوند و در آنژیوگرافی کاملاً مشخص است. در بیشتر موارد ثبت شده در مقالات تومور در ناحیه Parasellar
قرار داشته است. در بررسی ما, تمامی بیماران دارای انسداد/ تنگی در شریان
کاروتید داخلی یا یکی از شاخه های اصلی آن بودند. تعداد عروق مبتلا با هیچ
کدام از پارامترهای مورد مطالعه ما مرتبط نبود. با این وجود ما متوجه
ارتباط بین حجم درمانی و دوره نهفته شدیم. بیمارانی که فقط با میدان involved درمان شدند, دوره نهفته کوتاهتری داشتند. این یافته ها می توانند نتیجه دوز مجموع بیشتر در چرخه willis در مقایسه با تمام مغز یا تابش کرانیواسپانیال باشد که حجم ترکیبی لزوماً در ناحیه Parasellar نیست.
علاوه بر تشعشع, تومورهای مغزی به صورت مکرر با جراحی و شیمی درمانی نیز درمان می شوند. در یک مورد گزارش شده بوسیله Rudoltz و همکارانش ( 33 ), یک پسر 5 ساله با Cranio pharyngioma پس از جراحی و پرتودرمانی مبتلا به ضایعه عروقی ipsilateral
شد. دستکاری عروق مغزی در جراحی احتمالاً بیمار را مستعد اختلالات عروقی
کرده است. به علاوه شیمی درمانی احتمالاً باعث کاهش مقاومت عروق در برابر
پرتو می شود چون شیمی درمانی آسیب ناشی از تشعشع به سایر اندامها را
افزایش می دهد (39). شیمی درمانی در ترکیب با پرتودرمانی باعث ایجاد
التهاب می شود و می تواند باعث ایجاد اختلال عروق موضعی شود (40). در
مطالعه ما, هر دو روش جراحی و شیمی درمانی, عوامل معنی دار آماری در ایجاد
سندروم مویا مویا ناشی از تابش نبودند.
با تلاش بیشتر, حیات بیماران مبتلا به تومور مغزی به طور مشخص افزایش یافته است. بنابراین پی گیری کودکانی که برای درمان تومور Para sellar تحت پرتودرمانی قرار گرفته اند, بویژه آنهایی که به NF-1
نیز مبتلا هستند در آشکارسازی سندروم مویا مویا, حیاتی است. آنژیوگرافی
بهترین روش تشخیص سندروم مویا مویا است ولی روشهای کمتر تهاجمی برای
استفاده مکرر مورد نیاز هستند. بیماران مبتلا به سندروم مویا مویا به
درستی با MR Angiography و یا CT
پایش می شوند (40 ). اینکه آیا آشکارسازی سریع عروق سندروم مویا مویا با
استفاده از این روشهای تصویربرداری در بیماران بدون علامت منجر به شیوع
کمتر سکته می شود یا خیر, روشن نیست.
مطمئناً این مطالعه دارای
محدودیتهایی است. اولین آنها پیشقدر ذاتی انتخاب است یعنی موارد گزارش شده
در مقالات اغلب افراد مبتلا هستند و لذا پی گیری آنها مشکل است. بنابراین
موارد سندروم مویامویا ممکن است به دلیل کوتاه بودن دوره پی گیری گزارش
نشوند. دوم اینکه بیماران با NF-1
مثبت در این بررسی ممکن است حتی بدون پرتودرمانی به سندروم مویامویا مبتلا
باشند و لذا آنها مستعد این شرایط هستند. بحثی در اینجا مطرح می شود که
سندروم مویا مویا ممکن است در اطفال مبتلا به NF-1 زودتر ایجاد شود. با این وجود دوره نهفته برای بیماران NF-1
مثبت و منفی در مطالعه ما خیلی متفاوت نبود. با این همه این مطالعه بسیار
مهم است چون مروری منظم است بر آنچه در مورد این شرایط غیر عادی پس از
پرتودرمانی وجود دارد.نتیجه گیری :
بر اساس مرور مقالات گذشته, دریافتیم که بیمارانی که در ناحیه Parasellar
تحت پرتودرمانی قرار می گیرند بیشتر به سندروم مویامویا مبتلا می شوند. به
علاوه خطر سندروم مویامویا با گذشت زمان افزایش می یابد. نیمی از موارد در
4 سال پس از پرتودرمانی ایجاد می شود و 95% موارد در طول 12 سال پس از
تابش رخ می دهد. بیماران با NF-1 نیز دارای آستانه دوز تشعشع کمتری برای ایجاد سندروم مویا مویا تومور Parasellar هستند و این گروه بیشترین افراد مستعد به سندروم مویا مویا هستند.

سونوگرافی(Ultrasound) چیست؟
ریشه لغوی
کلمه سونوگرافی از لفظ لاتین sound به معنی صوت و نیز graphic به معنی شکل و ترسیم گرفته شده و ultrasound از ultra به معنی ماورا و نیز sound به معنی صوت یا صدا گرفته شده است.
تاریخچه
در
سال 1876 میلادی ، فرانسیس گالتون برای اولین بار پی بوجود امواج فراصوت
برد. در زمان جنگ جهانی اول کشور انگلستان برای کمک به جلوگیری از غرق شدن
غم انگیز کشتیهایش توسط زیردریاییهای کشور آلمان در اقیانوس آتلانتیک
شمالی دستگاه کشف کننده زیردریاییها به کمک امواج صوتی به نام Sonar
ابداع کرد. این دستگاه امواج فراصوت تولید میکرد که در پید اکردن مسیر
کشتیها استفاده میشد. این تکنیک در زمان جنگ جهانی دوم تکمیل گردید و
بعدها بطور گستردهای در صنعت این کشور برای آشکار سازی شکافها در فلزات و
سایر موارد مورد استفاده قرار میگرفت. از کاربرد بخصوصی که انعکاس صوت در
جنگ و صنعت داشت Sonar به علم پزشکی وارد شد و تبدیل به یک وسیله تشخیصی بزرگ در علم پزشکی گردید. 
سیر تحولی در رشد
نخستین
دستگاه تولید کننده امواج فراصوت در پزشکی ، در سال 1937 میلادی توسط
دوسیک اختراع شد و روی مغز انسان امتحان شد. اگر چه اولتراسوند در ابتدا
فقط برای مشخص کردن خط وسط مغز بود، اکنون بصورت یک روش تشخیصی و درمانی
مهم در آمده و پیشرفت روز به روز انواع نسلهای دستگاههای تولید اولتراسوند
، تحولات عظیمی در تشخیص و درمان در علم پزشکی بوجود آورده است.
تعریف امواج اولتراسوند (فراصوت)
امواج
فراصوت به شکلی از انرژی از امواج مکانیکی گفته میشود که فرکانس آنها
بالاتر از حد شنوایی انسان باشد. گوش انسان قادر است امواج بین 20 هرتز تا
20000 هرتز را بشنود. هر موج (شنوایی یا فراصوت) یک آشفتگی مکانیکی در یک
محیط گاز ، مایع و یا جامد است که به بیرون از چشمه صوتی و با سرعتی
یکنواخت و معین حرکت میکند. در حرکت یا گسیل موج مکانیکی ، ماده منتقل
نمیشود. اگر ارتعاش ذرات در جهت عمود بر انتشار صوت باشد، موج عرضی است
که بیشتر در جامدات رخ میدهد و در صورتی که ارتعاش در راستای انتشار
امواج باشد، موج طولی است. انتشار در بافتهای بدن به صورت امواج طولی است.
از این رو در پزشکی با اینگونه امواج سر و کار داریم.
روشهای تولید امواج فراصوت
روش پیزو الکتریسیته
تاثیر
متقابل فشار مکانیکی و نیروی الکتریکی را در یک محیط اثر پیزو الکتریسیته
میگویند. بطور مثال بلورهایی وجود دارند که در اثر فشار مکانیکی ، نیروی
الکتریکی تولید میکنند و برعکس ایجاد اختلاف پتانسیل در دو سوی همین بلور
و در همین راستا باعث فشردگی و انبساط آنها میشود که ادامه دادن به این
فشردگی و انبساط باعث نوسان و تولید امواج میشود. مواد (بلورهای) دارای
این ویژگی را مواد پیزو الکتریک میگویند. اثر پیزو الکتریسیته فقط در
بلورهایی که دارای تقارن مرکزی نیستند، وجود دارد. بلور کوارتز از این
دسته مواد است و اولین مادهای بود که برای ایجاد امواج فراصوت از آن
استفاده میشد که اکنون هم استفاده میشود.
اگر چه مواد متبلور
طبیعی که دارای خاصیت پیزو الکتریسیته باشند، فراوان هستند. ولی در کاربرد
امواج فراصوت در پزشکی از کریستالهایی استفاده میشود که سرامیکی بوده و
بطور مصنوعی تهیه میشوند. از نمونه این نوع کریستالها ، مخلوطی از
زیرکونیت و تیتانیت سرب (Lead zirconat & Lead titanat)
است که به شدت دارای خاصیت پیزوالکتریسیته میباشند. به این مواد که
واسطهای برای تبدیل انرژی الکتریکی به انرژی مکانیکی و بالعکس هستند،
مبدل یا تراسدیوسر (transuscer)
میگویند. یک ترانسدیوسر اولتراسونیک بکار میرود که علامت الکتریکی را به
انرژی فراصوت تبدیل کند که به داخل بافت بدن نفوذ و انرژی فراصوت انعکاس
یافته را به علامت الکتریکی تبدیل کند.
روش مگنتو استریکسیون
این
خاصیت در مواد فرومغناطیس (مواد دارای دو قطبیهای مغناطیسی کوچک بطور خود
به خود با دو قطبیهای مجاور خود همخط شوند) تحت تاثیر میدان مغناطیسی
بوجود میآید. مواد مزبور در این میدانها تغییر طول میدهند و بسته به
فرکانس (شمارش زنشهای کامل موج در یک ثانیه) جریان متناوب به نوسان در
میآیند و میتوانند امواج فراصوت تولید کنند. این مواد در پزشکی کاربرد
ندارند و شدت امواج تولید شده به این روش کم است و بیشتر کاربرد
آزمایشگاهی دارد.
کاربرد امواج فراصوت
1. کاربرد تشخیصی (سونوگرافی)
2. بیماریهای زنان و زایمان (Gynocology) مانند بررسی قلب جنین ، اندازه گیری قطر سر (سن جنین) ، بررسی جایگاه اتصال جفت و محل ناف ، تومورهای پستان.
3. بیماریهای مغز و اعصاب (Neurology) مانند بررسی تومور مغزی ، خونریزی مغزی به صورت اکوگرام مغزی یا اکوانسفالوگرافی.
4. بیماریهای چشم (ophthalmalogy) مانند تشخیص اجسام خارجی در درون چشم ، تومور عصبی ، خونریزی شبکیه ، اندازه گیری قطر چشم ، فاصله عدسی از شبکیه.
5. بیماریهای کبدی (Hepatic) مانند بررسی کیست و آبسه کبدی.
6. بیماریهای قلبی (cardology) مانند بررسی اکوکار دیوگرافی.
7. دندانپزشکی مانند اندازهگیری ضخامت بافت نرم در حفرههای دهانی.
8. این امواج به علت اینکه مانند تشعشعات یونیزان عمل نمیکنند. بنابراین برای زنان و کودکان بیخطر میباشند.
9. کاربرد درمانی (سونوتراپی)
10. کاربرد گرمایی
با
جذب امواج فراصوت بوسیله بدن بخشی از انرژی آن به گرما تبدیل میشود.
گرمای موضعی حاصل از جذب امواج فراصوت بهبودی را تسریع میکند. قابلیت
کشسانی کلاژن (پروتئینی ارتجاعی) را افزایش میدهد. کشش در scars
(اسکار=جوشگاههای زخم) افزایش میدهد و باعث بهبود آنها میشود. اگر اسکار
به بافتهای زیرین خود چسبیده باشد، باعث آزاد شدن آنها میشود. گرمای حاصل
از امواج فراصوت با گرمای حاصل از گرمایش متفاوت است.
میکروماساژ مکانیکی
به
هنگام فشردگی و انبساط محیط ، امواج طولی فراصوتی روی بافت اثر میگذارند
و باعث جابجایی آب میان بافتی و در نتیجه باعث کاهش ورم (تجمع آب میان
بافتی در اثر ضربه به یک محل) میشوند.
درمان آسیب تازه و ورم
:آسیب تازه معمولا با ورم همراه است. فراصوت در بسیاری از موارد برای از
بین بردن مواد دفعی در اثر ضربه و کاهش خطر چسبندگی بافتها بهم بکار
میرود.
درمان ورم کهنه یا مزمن :فراصوت چسبندگیهایی که میان ساختمانهای مجاور ممکن است ایجاد شود را میشکند.
خطرات اولتراسوند
سوختگی
اگر امواج پیوسته و در یک مکان بدون چرخش بکار روند، در بافت باعث سوختگی میشود و باید امواج حرکت داده شوند.
پارگی کروموزومی
استفاده دراز مدت از امواج اولتراسوند با شدت خیلی بالا پارگی در رشته دی ان ای (DNA) را نشان میدهد.
ایجاد حفره یا کاویتاسیون
یکی
از عوامل کاهش انرژی امواج اولتراسوند هنگام گذشتن از بافتهای بدن ایجاد
حفره یا کاویتاسیون میباشد. همه محلولها شامل مقدار قابل ملاحظهای
حبابهای گاز غیر قابل دیدن هستند و دامنه بزرگ نوسانهای امواج اولتراسوند
در داخل محلولها میتواند بر روی بافتها تغییرات بیولوژیکی ایجاد کند
(پارگی در دیواره سلولها و از هم گسستن مولکولهای بزرگ).

هایپرترمی
در
اساطیر یونان پرومتوس نیم خدایی که آتش را از المپوس دزدید و استفاده از
آن را به انسان آموخت ، پدر هایپرترمی شناخته می شود . او برای این عمل به
وسیله زئوس ، خدای خدایان ، به صخره ای زنجیر شده وهر روز کرکسی از جگرش
تغذیه می کرد .
مسلماً استفاده از هایپرترمی برای درمان سرطان روش
جدیدی نیست . اولین مصحف پزشکی شناخته شده تا به امروز ، حاوی مطالعه
موردی بیماری می باشد که برای درمان سرطان پستان با هایپرترمی معالجه شده
است . این مورد در پاپیروس پزشکی ادوین اسمیت ، یک پاپیروس مصری متعلق به
بیش از 5000 سال قبل ، پیدا شده است . بعدها از گرما در تمام فرهنگها به
عنوان یکی از مهمترین روشهای درمان پزشکی تقریباً برای هر نوع بیماری از
جمله سرطان استفاده شد . شاید به همین دلیل باشد که بقراط ( 377 _ 470 قبل
از میلاد ) در یکی از سخنرانیهای مهم خود این گونه بیان کرد :
“ Quae
medicamenta non sanat, ferum sanat. Quae ferum nonsanat, ignis sanat,
Quae vergo ignis nonsanat, insanobilia reportari oportet.”
” آنهایی
که با دارو درمان نمی شوند ، با جراحی درمان می شوند . آنهایی که با جراحی
درمان نمی شوند ، با آتش ( هایپرترمی ) درمان می شوند . آنهایی که با آتش
درمان نمی شوند ، به واقع علاج ناپذیرند ."
در حال حاضر تلاش برای
مطالعه دماهای بالا برای درمان سرطان از تاریخچه ای طولانی تر از پرتوهای
یونساز برخوردار است . در سال 1866 ، 30 سال قبل از کشف " پرتو جدید " به
وسیله رنتگن ، یک پزشک آلمانی به نام دبیلوبوش بیماری مبتلا به سارکوما در
صورت را توصیف می کند که پس از یک عفونت طولانی مدت ناشی از باد سرخ _ یک
بیماری عفونی که با تب بالا همراه است _ سارکوما ناپدید شد . این گزارش و
موارد مشابه آن ، جراحی در نیویورک به نام ویلیام ب کولی را به این فکر
انداخت که ممکن است باکتری ایجاد کننده باد سرخ علیه سرطان مؤثر باشد . به
همین منظور او توکسینی را جداسازی کرد ( توکسین کولی ، یا توکسین مخلوط
باکتریایی ) که با آن تعدادی از بیماران را معالجه نمود .
اگر چه
ارزیابی نقش مستقیم گرما در این ترکیب هایپرترمی کل بدن و ایمنوتراپی
نامشخص مشکل است ، کارکولی موجب شروع تعدادی دیگر از بررسیها با هایپرترمی
موضعی گردید که به تومورهای بیماران و حیوانات آزمایشگاهی داده شد . در
سال 1898 وسترمارک ، یک متخصص زنان سوئدی ، مقاله ای را مبنی بر بهبودی
قابل توجه کارسینوماهای بزرگ دهانه رحم بعد از هایپرترمی موضعی منتشر کرد
؛ اگر چه معالجه ها از کنترل خوبی برخوردار نبودند و موارد عمدتاً به قصه
شباهت دارند . استفاده از هایپرترمی بتنهایی یا به صورت ترکیب یا تشعشع در
فواصل نا منظم طی سالها مورد بررسی قرار گرفت اما هرگز جایگاهی دائمی در
کنترل و اداره سرطان پیدا نکرد . مرور تاریخی استفاده بالینی اولیه از
هایپرترمی را می توان در چندین مقاله علمی یافت ( برای مثال ، به وسیله
دوی و همکاران ، 1977 ؛ و اوورگارد ، 1984 ) .
در حال حاضر توجه به
هایپرترمی برمبنای شواهد مستند بالینی بهبود تومور و نیز توجیه بیولوژیکی
و نتایج ترغیب کننده از تجربیات آزمایشگاهی استوار می باشد .
روشهای گرمادهی
مشکل
عمده توسعه هایپرترمی بالینی برای درمان سرطان ، طراحی دستگاهی برای گرم
کردن دقیق و یکنواخت حجمهای معینی از تومور می باشد . روشهای گرمادهی
موضعی عبارتند از : (1) دیاترمی موج کوتاه ؛ (2) جریانهای القایی
رادیوفرکانس ؛ (3) میکروویو و (4) اولتراسوند .
بیشتر کارهای انجام شده
با سلولهای کشت شده در in vitro و نیز بیشتر تجربیات آزمایشگاهی اولیه با
حیوانات مستلزم گرمادهی با حمام آب گرم بوده است . ساده ترین و قابل
اعتمادترین روش برای گرم کردن یک ظرف پتری یا یک تومور پیوند شده به یک
پای موش ، فرو بردن کامل آن در یک حمام آب گرم قابل کنترل با ترموستات می
باشد . دمای آب را می توان تا حد کسری از درجه کنترل کرد ؛ اندازه گیری
دما به هیچ وجه مشکل نیست . گرچه حتی در این وضعیتهای ساده نیز تومور با
پوست هم دما نباشد .
شایان ذکر است در صورت ایجاد هیپرترمی موضعی به
وسیله میکروویو ، جریانهای القایی رادیوفرکانس ، یا اولتراسوند ، مشکلات
فنی و محدودیتهایی وجود خواهد داشت . در مورد میکروویو ، مکانیابی خوب را
می توان در عمقهای کم به دست آورد اما در عمقهای تومور بزرگتر _ حتی در
صورت کاهش بسامد برای نفوذ بیشتر ، مکانیابی ضعیفتر و گرمای سطحی موجب
محدود شدن درمان می شود . اگر از اولتراسوند استفاده شود ، وجود استخوان
یا حفره های هوا موجب از بین رفتن الگوی گرمادهی می شود ؛ اما نفوذ مناسب
و توزیع یکنواخت و خوب دما ، بویژه به وسیله اولتراسوند ، را می توان در
بافتهای نرم داشت . بنابراین ، در عمل تومورهایی مانند ندولهای عود کننده
دیواره قفسه سینه را می توان بخوبی با میکروویو درمان کرد و باید از نظر
تئوری امکان گرمادهی تومورهای عمقی زیر دیافراگم با اولتراسوند کانونی شده
، میکروویو ناحیه ای ، یا روشهای داخل نسجی وجود داشته باشد .
به هر
حال ، در تمام موارد روشهای موجود گرمادهی از مشکلاتی برخوردارند گرچه
پیشرفت قابل توجهی در نتیجه کاربرد هوشمندانه آرایشهای کانونی حاصل شده
است . برای مثال ، استفاده از آرایشهای چند مرحله ای ، یکنواختی دما در
لبه میدان را میسر می سازد . موضع پیچیده ای است و احتمال یافتن پاسخی
ساده به تمام پرسشهای پیچیده بسیار کم خواهد بود . پس ، این محدوده ،
حیطه ای از تحقیق است که ضرورت توسعه های مهندسی در آن مشهود بوده و از
پیشرفتهای علوم پایه استقبال می شود .
یکی از روشهای ایجاد هایپرترمی
موضعی _ که از مشکلات کمتری برخوردار است _ استفاده از چشمه های
رادیوفرکانس یا میکروویو کاشته شده در بافت می باشد . در صورت
اعمال جریانهای القایی رادیوفرکانس یا میکروویو به آرایشی از مفتولهای
کاشته شده واقع در تومور و بافتهای اطراف می توان توزیع خوب دما را ایجاد
و حفظ کرد . " مفتولهای " استفاده شده گاهی چشمه رادیواکتیو می باشند به
گونه ای که گرما و تشعشع باهم توأم می شوند . در مقابل آنتن دو طرفه
میکروویو را می توان در کانترهای مورد استفاده برای نگهداشتن مفتولهای
ایریدیم_92 رادیواکتیو جایسازی و حجم تومورهای عمقی را از داخل به طرف
خارج گرم کرد . بعضی از نتایج امیدوارکننده با این روش برای تعدادی از
بیماران سرطانی _ که کاشت داخل نسجی برای آنان عملی بوده است _ حاصل شده
است.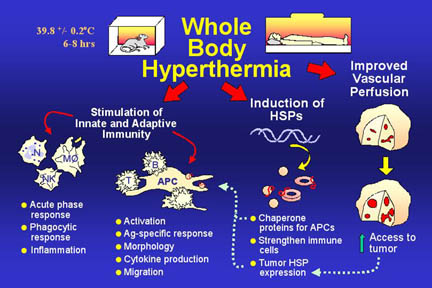
پاسخ سلولی به گرما
گرما
سلولها را به روشی قابل تکرار و قابل پیش بینی می کشد . شکل 28-1 یک سری
از منحنیهای بقای سلول را برای سلولهایی نشان می دهد که در معرض دماهای
مختلف از ˚C 5/41 تا ˚C5/46 قرار گرفتند . منحنیهای بقای سلول برای گرما
در شکل ، مشابه منحنیهای حاصل از اشعه ایکس می باشد ( یعنی یک شانه اولیه
و متعاقب آن شیب نمایی وجود دارد ) ، جز آنکه زمان در معرض قرارگرفتن به
دماهای مختلف جایگزین دز جذبی اشعه ایکس می شود . برای دماهای کمتر ،
تصویر پیچیده تر است زیرا منحنیهای بقا بعد از تابش دراز مدت هایپرترمی
یکنواخت و صاف می شود ؛ این مسأله مبین توسعه مقاوت یا تحمل به دماهای
بالاتر است که بعداً در همین فصل توضیح داده می شود . مشابهت شکل منحنیهای
بقای سلول حاصل از گرما و اشعه ایکس گمراه کننده است . بنابراین نتیجه
گیری نکردن برای گرما بر مبنای تفسیر منحنیهای پاسخ _ دز تشعشع حائز اهمیت
است زیرا مقدار انرژی مستلزم در غیر فعال نمودن سلول برای گرما هزاران
برابر بیشتر از اشعه ایکس است . این امر منعکس کننده مکانیزمهای متفاوت
دخیل در مرگ سلول در اثر حرارات و اشعه ایکس می باشد .
تعداد منحنیهای
بقا مشابه با موارد نشان داده شده در شکل 28-1 برای بسیاری از انواع
سلولهای مختلف به دست آمده است ؛ واضح است سلولها به طور گسترده ای در
حساسیت به هایپرترمی متفاوتند . همانند پرتوهای یونساز، تفاوت یکنواختی
بین سلولهای سالم و بدخیم _ علیرغم گزارشهای منفرد متعددی که مدعی حساسیت
ذاتی بیشتر سلولهای تومور به حرارت در مقایسه با بافتهای سالم مشابه می
باشد _ وجود ندارد .
داده های بقا برای سلولهای قرار گرفته در معرض
دماهای مختلف هایپرترمی ( برگرفته از شکل 28-1 ) در شکل 28-2 با نشان دادن
0 D / 1 در محور عمودی و T/1 در محور افقی دوباره ترسیم شده است . T، دمای
مطلق است ؛ 0D عکس شیب ناحیه نمایی منحنی بقا ( یعنی مدت زمان برای درمان
معینی که برای کاهش نسبت سلولهای زنده به 37% مقدار اولیه لازم است ) می
باشد . این نوع نمایش به نام طرح ( نمودار ) آرینوس معروف است ؛ شیب آن
انرژی فعال شدن فرایند شیمیایی مستلزم در مرگ سلول را نشان می دهد .
تغییر
شیب _ که در دمایی حدود ˚C43 روی می دهد _ به معنای متفاوت بودن انرژی
فعال شدن بالا و پائین این دما است و منعکس کننده مکانیزمهای متفاوت کشتن
سلول می باشد ( یعنی هدفهای متفاوت برای سیتوتوکسیسیته بالاتر و پائینتر
از دمای ˚C 43 ) . از سوی دیگر ، ممکن است به همین نسبت تحمل گرمایی تظاهر
نماید . پائینتر از ˚C43 ، تحمل گرمایی بتدریج طی گرمادهی توسعه می یابد ،
این پدیده بالاتر از ˚C43 روی نمی دهد . بر این مبنا، حساسیت ذاتی به گرما
بالای ˚C43 مشاهده می شود ؛ بقای سلول برای گرمادهی پیوسته پائینتر از این
دما، بیانگر حساسیت حرارتی تعدیل شده با القای از بین رفتن تحمل گرمایی می
باشد . مشابهت انرژی فعال شدن برای دگر سرشتی پروتئین با انرژی فعال شدن
برای سیتوتوکسیسیته حرارتی ، محاسبه شده از آنالیز آرینوس ، به فرضیه ای
منجر شد که هدف برای کشتن سلول با حرارت پروتئین است . پروتئینهای ساختاری
کروموزومی ، ماتریس هسته ای و آنزیمهای ترمیم اسکلت سلولی و اجزای غشادار
تماماً به عنوان اهداف احتمالی شناخته شده اند که با هیپرترمی تغییر ماهیت
می دهند .
نمودار آرینوس برای یک رده سلولی مشخص را می توان با تعدادی
از موارد تعدیل نمود . برای مثال ، تغییر pH سلولها منحنیها را بالا می
برد ، و نقطه شکست در دمای بالاتر روی می دهد .
پروتئینهای شوک حرارتی
اگر
سلولها در معرض گرما قرار گیرند ، پروتئینهای با وزن مولکولی مشخص( عمدتاً
kd70 یا kd90 ) تولید می شوند . تظاهر این پروتئینهای شوک _ حرارتی با
توسعه تحمل گرمایی همزمان و ناپدید شدن آنها با از بین رفتن تحمل گرمایی
همزمان و ناپدید شدن آنها با از بین رفتن تحمل گرمایی همراه است . علیرغم
وضوح رابطه مشخص نیست پروتئینهای شوک حرارتی در مکانیزم ایجاد تحمل گرمایی
دخالت دارند یا تظاهر مستقل از آزار گرمایی است _ در واقع ، اگر چه به
آنها نام پروتئینهای شوک حرارتی را داده اند ، پس از تیمار با دیگر عوامل
، از جمله آرسنیت و اتانول نیز تولید می شوند . پروتئینهای با وزن مولکولی
تقریباً مشابه در سلولهای بسیاری از گونه ها ،در واقع برای اولین بار در
مگس میوه (دروزوفیلا) ، کشف شده است . آنها ظاهراً پاسخ سلولی فوری به
استرس می باشند .
پروتئینهای شوک حرارتی با ژل الکتروفورز مشخص می شوند
و نوارهای کاملاً واضح و وزنهای مولکولی خاصی را نشان می دهند . از
میتونین نشاندار شده با سولفور_75 برای نشاندار کردن پروتئین در سلولهای
تیمار شده استفاده و آنگاه در ژل پلی آکریل آمید در میدان الکتریکی قرار
داده شد . پروتئینها مسافتی را طی می کنند که به وزن مولکولی آنها بستگی
دارد ؛ پروتئینهای کوچکتر مسافت بیشتری را در ژل طی می کنند . این عمل
موجب جدا شدن پروتئینهای مختلف در سلول می شود ( شکل 28-6 ) . پس از تیمار
سلولها در دمای ˚C45 به مدت 20 دقیقه ، پروتئینهایی که فقط در مقادیر کم
قبل از تیمار گرمایی حضور دارند چند ساعت بعد سنتز می شوند . مقایسه با
شاهد ، وزن مولکولی kd70 تا kd110 را نشان می دهد . زمان تظاهر این
پروتئینها مقارن با توسعه تحمل گرمایی است .
کاربردهای انسانی
هایپرترمی
به طور گسترده ای به عنوان شکلی از درمان سرطان مورد استفاده قرار گرفته
است . استفاده از آن برای درمان تومورهای انسان به برگردانهای اولیه متون
به وسیله راماجاما ( 2000 سال قبل از میلاد ) بر می گردد . درسال 1891 ،
کولی متوجه شد بهبود یک سارکومای سلول گرد گردن غیر قابل جراحی با مرض باد
سرخ تب آلود همراه بود . در این مرحله مشخص نبود که کوچک شدن تومور ناشی
از تب یا اثر مستقیم توکسینهای باکتریایی است . در سال 1953 ، ناتز ،
فاولر و بوگاتکو کار کولی را گزارش کردند ؛ 25 بیمار از 30 بیمار انتخاب
شده با سارکومای بافت نرم ، لنفوسارکوما ، یا کارسینومای دهانه رحم و
پستان تا ده سال بعد بدون بیماری زنده بودند . نتایج اولیه کولی با عوامل
بسیار تب زا ، هرگز با عوامل کمتر یا هایپرترمی سیستمیک برابری نکرد ، به
هر حال ، شاید به جای توکسین ، تب عامل کشنده تومور بوده است . به دلیل
تحت تاثیر قرار گرفتن بدون شک سیستم ایمنی از توکسینهای کولی ، می توان
تصور کرد در بیمارانی که در آنها درمان دایمی حاصل شده است ، این اثر می
تواند نتیجه تحریک سیستم ایمنی به جای اثر مستقیم حرارتی بر تومور بوده
باشد .
مکانیزمهای عمل هایپرترمی
هایپرترمی
موجب ایجاد آثاری در هسته و سیتوپلاسم سلول می شود . روشن نیست آثار حرارت
در هسته مانند ممانعت از فعالیت پلیمراز ، سنتز DNA و ناهنجاریهای
کروموزومی آثار مستقیم گرما در هسته یا آثار ثانویه آن بر غشاها ،
ساختمانهای داخل سلولی و اسکلت سلولی می باشند . ظاهراً اثر کشنده گرما
همراه با تخریب یا دگرسرشتی پروتئینها ، با اثر کشنده تشعشع _ که بوضوح
مستلزم ایجاد آسیب اولیه در مولکول DNA است _ متفاوت می باشد .
علیرغم
امکان تفاوت در مراحل واسطه ، اثر سیتوتوکسیک نهایی گرما و تشعشع بویژه
برای سلولهای تیمار شده در مرحله S چرخه سلول ، در سطح DNA ایجاد می شود
. برای سلولها در شرایط in vitro ، گرما در مرحله S ناهنجاریهای کروموزومی
ایجاد می کند و برای سطح معینی از مرگ سلول ناشی از گرمای تنها یا گرمای
همراه با تشعشع ، فراوانی و انواع ناهنجاریهای کروموزومی به گونه ای نزدیک
با نتایج تشعشع تنها مطابقت می نماید ؛ یعنی ، یک ناهنجاری مطابق با بقای
37% است . به هر حال ، در بافتهای سازمان یافته ، آسیب گرمایی سریعتر از
آسیب تشعشع روی می دهد زیرا سلولهای تمایز یافته بخوبی سلولهای در حال
تقسیم کشته می شوند . همچنین سلولها با روش اپوپتوز دچار مرگ می شوند .
وقایع
همراه با حساسیت پرتوی گرما مستلزم آسیب DNA و مهار ترمیم آن می باشد .
هایپرترمی اثری عکس بر مقدار آسیب DNA ناشی از تشعشع به فرم پارگیهای تک
رشته یا دو رشته دارد . ظاهراً نقش گرما ممانعت از فرایند ترمیم آسیبهای
ناشی از تشعشع می باشد .
فوتوتراپی
درمان بوسیله نور آفتاب
این نوع درمانی که «هلیوتراپی» (Heliotherapie) نامیده میشود که از قدیم در پزشکی معمول بوده و عبارت است از قرار دادن بدن برهنه در مقابل اشعه آفتاب. در ترکیب طیف آفتاب عوامل متعددی دخالت دارد که مهمترین آنها ارتفاع محل ، آب و هوا ، فصل و مقدار رطوبت ، وجود دود ، گرد و غبار هوا ، ساعات مختلف روز و ... میباشد. نسبت اشعه فرابنفش در کوهستانها از نقاط کم ارتفاع بیشتر است و علت خشکی هوا و نبودن دود و گرد و غبار میباشد.
درمان با نورهای رنگین
این نوع درمان «کرموتراپی» (Chormotherapie) نامیده میشود. رنگهای مختلف طیف خواص فیزیولوژیکی متفاوت دارد. رنگ قرمز اعصاب را تحریک میکند و در کارگرانی که مدت طولانی در کارگاههایی که به رنگ قرمز است، کار میکنند، حالت عصبی تولید میکند. در صورتی که رنگ سبز آرامش میدهد. رنگ قرمز در سیر تکاملی بثورات جلدی (آبله ، سرخک ، مخملک و ...) موثر است. این مسئله را ایرانیان قدیم بخوبی تشخیص داده بودند و به بیماران مبتلا به آبله و سرخک توصیه مینمودند که جلوی در و پنجرهها پرده قرمزی بیاویزند.
 رنگ آبی در اعصاب اثر تسکینی دارد و پزشکان بیماریهای روانی از این خاصیت استفاده میکنند. همچنین به نظر میرسد که دردهای عصبی و روماتیسم را نیز تا حدی تسکین دهد.
رنگ آبی در اعصاب اثر تسکینی دارد و پزشکان بیماریهای روانی از این خاصیت استفاده میکنند. همچنین به نظر میرسد که دردهای عصبی و روماتیسم را نیز تا حدی تسکین دهد.
استفاده از منابع مصنوعی
در جاهایی که از نور آفتاب نتوان استفاده نمود و یا در فصولی که نور آفتاب کم و استفاده از آن برای درمان مقدور نباشد، میتوان از منابع مصنوعی استفاده کرد. برای این کار معمولا اتاقکهایی به نام سولاریوم (Solorium) میسازند و در آنها منابع متعدد اشعه فرابنفش مانند قوس الکتریکی و یا چراغ بخار جیوه قرار میدهند. این نوع درمان در بیماریهای راشیتیسم و اختلالات تغذیه و کم خونی بکار میرود.

فوتوتراپی موضعی
اشعه مادون قرمز و نور مرئی
برای این معالجه صندوقچههایی میسازند که منابع اشعه (لامپ رشتهای) روی جدار داخلی آنها نصب شده است و قسمتی از بدن بیمار مانند دست و یا پا را که باید مورد معالجه واقع شود، درون صندوقچه قرار میدهند. این حمام حرارت سبب بالا رفتن حرارت پوست و پرخونی و تعریق موضعی میگردد. گاهی لازم است که تابش اشعه در هوای آزاد صورت گیرد تا عرق بخوبی تبخیر شود و به این طریق بعضی از اشکال روماتیسم مزمن را درمان میکنند.

امروز یکی از دوستان بدلیل اینکه پسرش به یبماری مویا مویا دچار شده است از من خواست برایش اطلاعاتی بدست بیاورم که به مقاله ی شما برخورد کردم خیلی برایم جالب بود تا الان نام این بیماری را هم نشنیده بودم ولی پسر دوستم شروع بیماریش با خونریزی مغزی همراه بود و الان یکطرف بدنش فلج است از شما خواهش میکنم در صورتی که این بیماری درمانی دارد راهنمایی فرمایید قبلا تشکر میکنم .